(14分)硫化物在自然界中的部分循环关系如下。
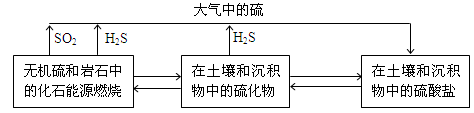
(1)H2S在空气中可以燃烧。
已知: 2H2S(g) + O2(g)  2S(s) + 2H2O(g) ΔH= -442.38 kJ/mol ①
2S(s) + 2H2O(g) ΔH= -442.38 kJ/mol ①
S(s) + O2(g)  SO2(g) ΔH=-297.04 kJ/mol ②
SO2(g) ΔH=-297.04 kJ/mol ②
H2S(g)与O2(g)反应产生SO2(g)和H2O(g)的热化学方程式是 。
(2)SO2是大气污染物,海水具有良好的吸收SO2的能力,其过程如下。
① SO2溶于海水生成H2SO3,H2SO3最终会电离出SO32—,其电离方程式是 。
② SO32—可以被海水中的溶解氧氧化为SO42—。海水的pH会 (填“升高” 、“不变”或“降低”)。
③ 为调整海水的pH,可加入新鲜的海水,使其中的HCO3—参与反应,其反应的离子方程式是 。
④ 在上述反应的同时需要大量鼓入空气,其原因是 。
(3)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS,慢慢转变为铜蓝(CuS),用化学用语表示由ZnS转变为CuS的过程: 。
(4)SO2和O2在H2SO4溶液中可以构成原电池,其负极反应式是 。
(14分,每空2分)
(1)2H2S(g)+3O2(g)  2SO2(g)+2H2O(g) ΔH= -1036.46 kJ/mol (方程式和计算各1分)
2SO2(g)+2H2O(g) ΔH= -1036.46 kJ/mol (方程式和计算各1分)
(2)① H2SO3 HSO3—+ H+ HSO3—
HSO3—+ H+ HSO3— SO3 2—+ H+ (每个1分)
SO3 2—+ H+ (每个1分)
② 降低
③ HCO3 —+ H+  CO2 ↑+ H2O(物质1分,配平1分)
CO2 ↑+ H2O(物质1分,配平1分)
④提高脱硫海水的溶解氧,将SO32-氧化成为SO42-,有利于平衡H2SO3 HSO3—+ H+ HSO3—
HSO3—+ H+ HSO3— SO3 2—+ H+ 正向移动(1分),提高二氧化硫的转化率,同时起到加快反应速率的作用(1分)。
SO3 2—+ H+ 正向移动(1分),提高二氧化硫的转化率,同时起到加快反应速率的作用(1分)。
(3)

(4)负极:SO2 - 2e—+ 2H2O  SO4 2—+ 4H+(物质1分,配平1分)
SO4 2—+ 4H+(物质1分,配平1分)
题目分析:(1)根据盖斯定律得目标方程式=①+2×②,所以H2S(g)与O2(g)反应产生SO2(g)和H2O(g)的热化学方程式是2H2S(g)+3O2(g) 2SO2(g)+2H2O(g) ΔH= -1036.46 kJ/mol
2SO2(g)+2H2O(g) ΔH= -1036.46 kJ/mol
(2)①亚硫酸是弱酸,分步电离得SO3 2—,电离方程式是H2SO3 HSO3—+ H+ HSO3—
HSO3—+ H+ HSO3— SO3 2—+ H+
SO3 2—+ H+
②SO32—可以被海水中的溶解氧氧化为SO42—,硫酸是强酸,溶液中的氢离子浓度增大,pH降低;
③新鲜的海水显酸性,与HCO3—反应生成二氧化碳和水,离子方程式为HCO3 —+ H+  CO2 ↑+ H2O
CO2 ↑+ H2O
④海水具有良好的吸收SO2的能力,大量鼓入空气,可以提高海水中的含氧量,将SO32-氧化成为SO42-,有利于平衡H2SO3 HSO3—+ H+ HSO3—
HSO3—+ H+ HSO3— SO3 2—+ H+ 正向移动,提高二氧化硫的转化率,同时起到加快反应速率的作用;
SO3 2—+ H+ 正向移动,提高二氧化硫的转化率,同时起到加快反应速率的作用;
(3)CuS比ZnS更难溶,硫化锌存在ZnS(s)  Zn2+(aq)+S2-(aq)平衡,当遇到硫酸铜溶液时,S2-与Cu2+结合生成CuS沉淀,使溶解平衡正向移动,最终ZnS全部转化为CuS,用化学用语表示为
Zn2+(aq)+S2-(aq)平衡,当遇到硫酸铜溶液时,S2-与Cu2+结合生成CuS沉淀,使溶解平衡正向移动,最终ZnS全部转化为CuS,用化学用语表示为

(4)负极发生氧化反应,元素化合价升高,所以是二氧化硫在负极发生反应,生成硫酸根离子,电极反应式为SO2 - 2e—+ 2H2O  SO4 2—+ 4H+
SO4 2—+ 4H+
