(15分)碳和氮的化合物与人类生产、生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应: Ni(s)+4CO(g)  Ni(CO)4(g),
Ni(CO)4(g), H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是
H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是
(填字母编号)。
A.增加Ni的量可提高CO的转化率,Ni的转化率降低
B.缩小容器容积,平衡右移, H减小
H减小
C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D.当4vNi(CO)4=v(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态(2)CO与镍反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫。
已知:C(s)+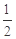 O2(g)==CO(g)
O2(g)==CO(g)  H= -Q1 kJ·mol-1
H= -Q1 kJ·mol-1
C(s)+ O2(g)==CO2(g)  H= -Q2 kJ·mol-1
H= -Q2 kJ·mol-1
S(s)+O2(g)==SO2(g)  H= -Q3 KJ·mol-1
H= -Q3 KJ·mol-1
则SO2(g)+2CO(g)==S(s)+2CO2(g)  H= kJ·mol-1。
H= kJ·mol-1。
(3)金属氧化物可被一氧化碳还原生成金属单质和二氧化碳。图(1)是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时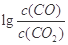 与温度(t)的关系曲线图。
与温度(t)的关系曲线图。
700oC时,其中最难被还原的金属氧化物是 (填化学式),用一氧化碳还原该金属氧化物时,若反应方程式系数为最简整数比,该反应的平衡常数(K)数值等于 。
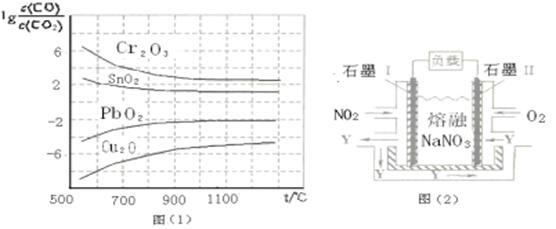
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如上图(2)所示。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为 。
若该燃料电池使用一段时间后,共收集到20mol Y,则理论上需要消耗标准状况下氧气的体积为 L。
(15分)
(1)C (3分)
(2)-(2Q2-2Q1-Q3) kJ·mol-1或(2Q1-2Q2+Q3)kJ·mol-1 (3分)
(3)Cr2O3 (3分) 10-12 (2分)
(4)NO2+NO3--e-=N2O5 (2分) 224(2分)
题目分析:(1)A、Ni是固体,浓度为常数,改变用量对平衡无影响,反应物的转化率不变,错误;B、一定温度下给定的化学方程式的△H不会随着平衡移动而改变,只与方程式的书写方式有关,错误;C、因外界条件为恒温恒容、Ni是固体且正反应为气体体积缩小的反应,所以反应达到平衡后充入CO,相当于在恒温恒压条件下达平衡后又加压,平衡右移,CO的转化率提高,平衡后其体积分数降低,正确;D、速率关系未说明正、逆,不能判断是否已达平衡,错误。
(2)已知的三个反应分别用①②③表示,运用盖斯定律可得,SO2(g)+2CO(g)═S(s)+2CO2(g)可由—①×2+②×2-③得到,则△H=-(2Q2-2Q1-Q3) kJ•mol-1或(2Q1-2Q2+Q3)kJ•mol-1
(3)700℃时,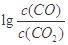 越大则K越小,说明反应进行的程度小,金属氧化物越难被还原,根据图像,Cr2O3对应的
越大则K越小,说明反应进行的程度小,金属氧化物越难被还原,根据图像,Cr2O3对应的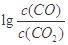 最大,所以Cr2O3最难被还原;此时Cr2O3对应的
最大,所以Cr2O3最难被还原;此时Cr2O3对应的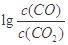 =4,得c(CO2)/c(CO)=10-4,结合Cr2O3与CO反应的化学方程式Cr2O3+3CO
=4,得c(CO2)/c(CO)=10-4,结合Cr2O3与CO反应的化学方程式Cr2O3+3CO 2Cr+3CO2,可得K="[" c(CO2)/c(CO)]3=10-12。
2Cr+3CO2,可得K="[" c(CO2)/c(CO)]3=10-12。
(4)石墨I电极上通入NO2,为负极,发生的电极反应为:NO2+NO3--e-=N2O5;根据电池总反应4NO2+O2=2N2O5,收集到20molN2O5需消耗O2为10mol,标准状况下体积为224L。
