(I)保护环境已成为当前和未来的一项全球性课题。为解决目前燃料使用过程中的环境污染问题,并缓解能源危机,有的专家提出利用太阳能促使燃料循环使用的构想,如图所示:

请回答下列问题:
(1)过程Ⅰ的能量转化形式为________能转化为________能。
(2)上述转化过程中,ΔH1和ΔH2的关系是________。
(3)断裂1 mol化学键所需的能量见下表:
| 共价键 | H—N | H—O | N≡N | O=O |
| 断裂1 mol化学键所需能量/(kJ·mol-1) | 393 | 460 | 941 | 499 |
(II)在一试管中加入0.01mol/L的KMnO4酸性溶液和0.1mol/LH2C2O4溶液,在恒温下发生如下反应:
2KMnO4+5 H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2+8H2O。5分钟后测得Mn2+的浓度为0.004mol/L;
(4)试计算0—5分钟内,υ(H2C2O4)=____________。
(5)如果反应从开始进行一段时间后,速率—时间图像如图: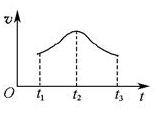 。试解释t1—t2,t2—t3速率变化的原因。______________________________________________________。
。试解释t1—t2,t2—t3速率变化的原因。______________________________________________________。
(I)(1)太阳 1分,化学 (1分)。 (2)△H1=-△H2 (1分)
(3)2N2(g)+6H2O(g)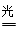 4NH3(g)+3O2(g) △H=+1189kJ/mol
4NH3(g)+3O2(g) △H=+1189kJ/mol (4分)
(4分)
(Ⅱ)(4)0.002md/(L·min) (2分)
(5)t1—t2说明Mn2+作催化剂;t2—t3:反应物浓度降低 (4分)
题目分析:(I)(1)根据转化示意图可知,过程I是利用太阳能将氮气、水和CO2等转化为氢气、氧气、氨气、甲醇和甲烷等,因此能量转化是太阳能转化为化学能。
(2)过程Ⅱ是在一定条件下氢气、氧气、氨气、甲醇和甲烷等又重新转化为CO2、水和氮气等,所以根据能量守恒可知△H1=-△H2。
(3)根据原子守恒可知,氮气与水反应生成氨气的同时还有氧气生成,反应的化学方程式为2N2+6H2O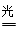 4NH3(g)+3O2。由于反应热等于断键吸收的能量与形成化学键所放出的能量的差值,则该反应的反应热△H=2×942kJ/mol+6×2×460kJ/mol-4×3×393kJ/mol-3×499kJ/mol=+1189kJ/mol,即热化学方程式为2N2(g)+6H2O(g)
4NH3(g)+3O2。由于反应热等于断键吸收的能量与形成化学键所放出的能量的差值,则该反应的反应热△H=2×942kJ/mol+6×2×460kJ/mol-4×3×393kJ/mol-3×499kJ/mol=+1189kJ/mol,即热化学方程式为2N2(g)+6H2O(g)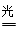 4NH3(g)+3O2(g) △H=+1189kJ/mol。
4NH3(g)+3O2(g) △H=+1189kJ/mol。
(Ⅱ)(4)5分钟后测得Mn2+的浓度为0.004mol/L ,则根据方程式可知消耗草酸的物质的量浓度是0.004mol/L× =0.01mol/L,所以反应速率υ(H2C2O4)=0.01mol/L ÷5min=0.002md/(L·min)。
(5)由于影响反应速率的因素一般有温度、浓度和催化剂等,体系温度不变,所以影响反应速率的因素可以从浓度和催化剂的角度分析。t1—t2反应速率升高,说明Mn2+作催化剂,加快了反应速率;而t2—t3后反应速率又降低,这说明反应物浓度降低导致反应速率降低。
