问题
计算题
(9分)恒温下,将a mol N2和b mol H2按一定比例混合,在相同状况下其密度是H2的 3.6倍,取5mol该混合气体通入密闭容器内,使之发生反应并在一定条件下达到平衡。已知反应达到平衡后容器内压强是相同条件下反应前压强的0.92倍,试求:
(1)反应前混合气体中N2和H2的体积比a﹕b=__________;
(2)达到平衡时混合气体中的H2、NH3的物质的量分别是_____mol、 mol;
(本小题请给推算过程)
(3)平衡时N2的转化率[n转化(N2)与n初始(N2)之比]________________。
答案
(1)1:4(2分)
(2)3.4、0.4
(3)20%(2分)
(1)1:4(2分)
(2)3.4、0.4
推算过程:设达平衡时转化的N2的物质的量为x
N2 + 3H2 2NH3
2NH3
起始/mol 1 4 0
转化/mol x 3x 2x
平衡/mol 1-x 4-3x 2x
依题意有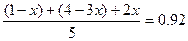 ,得x=0.2
,得x=0.2
n(H2)= 4-3x="3.4 " n(NH3)=2x=0.4(结果2分,过程3分,其他计算过程合理也给分)
(3)20%(2分)
