(14分)(Ⅰ)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇。
已知某些化学键的键能数据如下表:
| 化学键 | C—C | C—H | H—H | C—O | C≡O | H—O |
| 键能/kJ·mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
(1)已知CO中的C与O之间为叁键连接,则工业制备甲醇的热化学方程式为
;
(2)某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为2L的密闭容器内充入1 molCO和 2 molH2,加入合适催化剂(体积可以忽略不计)后在250°C开始反应,并用压力计监测容器内压强的变化如下:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
(3)下列描述中能说明上述反应已达平衡的是 ;
A.2 v (H2)正=" v" (CH3OH)逆
B.容器内气体的平均摩尔质量保持不变
C.容器中气体的压强保持不变
D.单位时间内生成 n molCO 的同时生成 2n molH2
(Ⅱ)回答下列问题:
(1)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,
则Ka(HX) ______ Ka(CH3COOH)(填>、<或=)

(2)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中C(CH3COO−)-c(Na+)=_________mol·L-1(填精确值)。
Ⅰ(1)CO(g)+2H2(g)  CH3OH(g) △H=" -116" KJ/mol
CH3OH(g) △H=" -116" KJ/mol
(2)0.0125mol/(L·min); 4 (mol/L)-2; 减小。
(3)B C
Ⅱ(1)> ; (2)9.9×10-7 。
题目分析:Ⅰ(1)CO(g)+2H2(g)  CH3OH(g) △H=" -116" KJ/mol
CH3OH(g) △H=" -116" KJ/mol
(2) CO(g) + 2H2(g)  CH3OH(g)
CH3OH(g)
起始: 1 mol 2 mol 0 mol
变化: x mol 2x mol x mol
平衡:(1-x)mol 2(1-x)mol x mol
依题意有以下关系式:(依据物质的量之比等于压强之比)

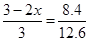 x=0.5
x=0.5
所以从反应开始到20min时,以CO表示的平均反应速率:v(CO)=
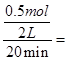 0.0125mol/(L·min); 平衡常数:k=
0.0125mol/(L·min); 平衡常数:k=
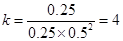
由第一小题可知该反应为放热反应,当升高温度时,平衡向着热的方向,也就是逆向移动,因此平衡常数的数值减小。
(3)A.错误,正确的应该为: v (H2)正 =" 2" v (CH3OH)逆 ; B.因为正向是气体物质的量减小的方向,而反应前后气体总的质量是不变的,只要是正向移动,混合气体的摩尔质量就会增大,反应就会减小,因此,容器内气体的平均摩尔质量保持不变时,一定是化学反应达到平衡状态之时,正确;C.同理,容器中气体的压强保持不变时,也是达到平衡状态之时;D.单位时间内生成 n molCO 的同时生成 2n molH2,这个关系式是永远存在的。因此选:B C
Ⅱ(1)从图中可以看出,加入相同量的水,HX的PH值变化大一点,也即HX这种酸酸性强一点,Ka(HX)>Ka(CH3COOH);
(2)依据电荷守恒,有以下关系式:c(CH3COO−)+c(OH-)=c(Na+)+c(H+)
所以有:c(CH3COO−)-c(Na+)=c(H+)-c(OH-)=10-6-10-8=9.9×10-7
