(14分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
SiO2+ C+ N2 Si3N4+ CO
Si3N4+ CO
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应中的氧化剂是_____________,其还原产物是_____________;
(3)该反应的平衡常数表达式为K=___________;
(4)若知上述反应为放热反应,则其反应热ΔH_______________零(填“大于”“小于”或“等于”);升高温度,其平衡常数值___________(填“增大”“减小”或“不变”);
(5)若使压强增大,则上述平衡向___________反应方向移动(填“正”或“逆”);
(6)若已知CO生成速率为v(CO)="18" mol·(L·min)-1,
则N2消耗速率为v(N2)=___________mol·(L·min)-1。
(1)3,6,2,1,6
(2)N2,Si3N4
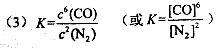
(4)小于;减小
(5)逆
(6)6
(1)利用氧化还原反应配平方法不难得出系数分别是3,6,2,1,6
(2)根据化合价变化可判断出N2为氧化剂,Si3N4为还原产物。
(3)根据平衡常数的定义得出该反应的平衡常数表达式为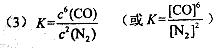
(4)放热反应,△H<0。升高温度平衡逆向移动,平衡常数减小。
(5)从配平后的化学方程式系数可以看出气态物质的系数之和是生成物的大于反应物的,故增大压强可使平衡逆向移动。
(6)同样从上述化学方程式系数关系中可以得出
V(N2)="2/6 " ×18 mol·L-1·min-1="6" mol·L-1·min-1
