(18分)MnO2和Zn是制造干电池的重要原料,工业上用软锰矿(主要成分MnO2)和闪锌矿(主要成分ZnS)联合生产MnO2和Zn的工艺流程如下图所示:

(1)操作I用到硅酸盐材质的仪器有烧杯、玻璃棒和_______ _____(填仪器名称)。
(2)稀硫酸浸泡时反应的离子方程式为_______________________________________;该反应中若析出19.2g单质A,共转移____________mo1电子。浸泡时反应速率较慢,下列措施不能提高浸泡时反应速率的是________(填代号)。
a.将矿石粉碎
b.提高浸泡温度
c.适当增大硫酸浓度
d.改变软锰矿与闪锌矿的比例
(3)由硫酸锰溶液可得到固体碳酸锰,然后在空气中煅烧碳酸锰制备MnO2。已知:
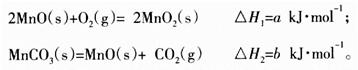
写出碳酸锰在空气中煅烧生成MnO2的热化学方程式_________________________。
(4)用惰性电极电解硫酸酸化的硫酸锰溶液制备MnO2的装置如下图所示:
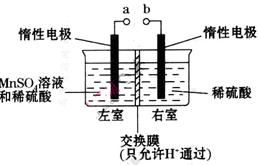
①a应与直流电源的_________(填“正”或“负”)极相连。.
②电解过程中氢离子的作用是______________和_____________;若转移的电子数为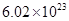 个,左室溶液中
个,左室溶液中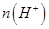 的变化量为________________。
的变化量为________________。
(1)漏斗
(2)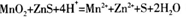 ;1.2;d
;1.2;d
(3)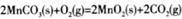 △H=(a+2b)kJ/mol;
△H=(a+2b)kJ/mol;
(4)①正②参与阴极反应;通过交换膜定向移动形成电流;1mol
题目分析:(1)操作I为过滤,用到硅酸盐材质的仪器有烧杯、玻璃棒和漏斗;(2)稀硫酸浸泡时反应为MnO2和ZnS变为Mn2+和Zn2+,同时应生成S单质,故方程式为: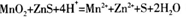 ;19.2g单质S的物质的量为0.6mol,由反应方程式可知生成1molS转移2mole-,故生成0.6molS转移1.2mole-;四个选项中,将矿石粉碎、提高浸泡温度、适当增大硫酸浓度均能提高反应速率,故答案为d;(3)由盖斯定律将反应I+II×2可得
;19.2g单质S的物质的量为0.6mol,由反应方程式可知生成1molS转移2mole-,故生成0.6molS转移1.2mole-;四个选项中,将矿石粉碎、提高浸泡温度、适当增大硫酸浓度均能提高反应速率,故答案为d;(3)由盖斯定律将反应I+II×2可得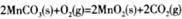 △H=(a+2b)kJ/mol;(4)①根据装置图可知左室发生MnSO4→MnO2的反应,即发生氧化反应,故a应与直流电源的正极相连;②电解过程中阴极为H+得电子发生还原反应,又交换膜只允许H+通过,故H+的作用为参与阴极反应且通过交换膜定向移动形成电流;若转移的电子数为
△H=(a+2b)kJ/mol;(4)①根据装置图可知左室发生MnSO4→MnO2的反应,即发生氧化反应,故a应与直流电源的正极相连;②电解过程中阴极为H+得电子发生还原反应,又交换膜只允许H+通过,故H+的作用为参与阴极反应且通过交换膜定向移动形成电流;若转移的电子数为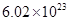 个即1mol,根据电荷守恒氢离子物质的量变化为1mol。
个即1mol,根据电荷守恒氢离子物质的量变化为1mol。
