问题
填空题
(9分)将4molSO2和2molO2的混合气体置于体积可变的恒压容器中,在一定条件下发生如下反应2SO2(g)+ O2(g) 2SO3(g) ΔH<0,该反应达平衡时,测得气体总物质的量为4.2mol,试回答:
2SO3(g) ΔH<0,该反应达平衡时,测得气体总物质的量为4.2mol,试回答:
(1)在该平衡时,n(SO3)= mol
(2)若起始时加入1.2molSO2、0.6molO2和xmolSO3,达到平衡时各气体体积分数与上述平衡状态相同,则x的取值范围是
(3)若反应开始时v(逆)> v(正),达到上述平衡状态时,气体的总物质的量仍为4.2mol,则起始时n(SO3)的取值范围是
(4)若反应过程中SO2、O2、SO3物质的量变化如图所示。则反应进行至20min时,曲线发生变化的原因是______________________(用文字表达)。10 min到15 min的曲线变化的原因可能是_________(填写编号)。
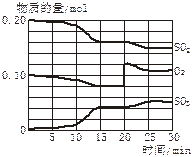
A.加了催化剂
B.缩小容器体积
C.降低温度
D.增加SO3的物质的量
答案
(1)3.6 (2分) (2)大于或等于0即 x≥0 (2分) (3)3.6<n(SO3)≤4(2分)
(4)增加了O2的量(1分) AB(2分)
