问题
填空题
氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)已知:H—H键能为436 kJ·mol—1,N≡N键能为946 kJ·mol—1,N—H键能为391 kJ·mol—1。写出合成氨反应的热化学方程式:
(2)恒温下,往一个4L的密闭容器中充人5.2molH2和2molN2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L—1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
②N2的平衡转化率
③此条件下该反应的化学平衡常数K=__________________________。反应达到平衡后,若维持容器体积不变,温度不变,往平衡体系中加入H2、N2和NH3各8mol,化学平衡将向_______方向移动(填“正反应”或“逆反应”)。
④若维持容器体积不变,只升高温度化学平衡常数值 (填变大、变小、不变),正反应速率 (填变大、变小、不变)。
⑤若温度维持不变,只将容器体积由4L变为2L,达新平衡时N2的平衡浓度 0.4 mol·L—1(填大于、小与、等于)
答案
(1)N2(g) + 3H2(g)  2NH3 (g) △H=-92kJ· mol-1(3分)
2NH3 (g) △H=-92kJ· mol-1(3分)
(2)①0.024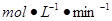 (2分) ②20%(2分)
(2分) ②20%(2分)
③ O.1[或0.1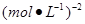 ] (2分) 正反应 (2分)
] (2分) 正反应 (2分)
④ 变小(2分),变大(2分)
⑤大于(2分)
