问题
选择题
反应2C + O2=2CO 的能量变化如图所示。含11.2g KOH的稀溶液与1L0.1mol/L的H2SO4溶液反应放出11.46kJ的热量,下列说法正确的是
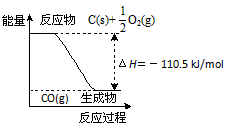
A.2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ
B.12 g C(s)与一定量O2(g)反应生成14 g CO(g),放出的热量为110.5 kJ
C.该反应的热化学方程式是2C(s) + O2(g)=2CO(g) ΔH=-110.5 kJ/mol
D.表示中和热的热化学方程式2KOH (aq) + H2SO4(aq) = K2SO4(aq)+2H2O (l) ΔH=-114.6 kJ/mol
答案
答案:A
