问题
选择题
向体积为2 L的密闭容器中充入2 mol SO2和1 mol O2,测得起始容器压强为p,一定条件下发生反应:2SO2(g)+O2(g)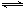 2SO3(g) △H=-196 kJ·mol-1,维持容器温度不变,测得平衡时容器内压强为0.7p,若此时再向容器中充入2 mol SO3,则下列说法正确的是
2SO3(g) △H=-196 kJ·mol-1,维持容器温度不变,测得平衡时容器内压强为0.7p,若此时再向容器中充入2 mol SO3,则下列说法正确的是
A.充入2 mol SO3后,SO2的物质的量增大
B.第一次反应达到平衡时共放出热量176.4 kJ
C.充入2 mol SO3达到新平衡时,容器内的压强为1.4p
D.降低容器的温度可使新平衡时各物质的体积分数与第一次平衡时相同
答案
AB
考查等效平衡问题
反应:2SO2(g)+O2(g)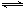 2SO3(g) △H=-196 kJ·mol-1
2SO3(g) △H=-196 kJ·mol-1
初始: 2 1 0
△n: 2x x 2x
平衡:2-2x 1-x 2x
恒容条件下,压强比与物质的量比相同,故3:(3—x)=10:7,得x=0.9mol
放出的热量:1:196=0.9:Q,得Q=176.4kJ
A:充入产物,平衡右移,SO2的物质的量增大,正确
B:正确
C:在恒容情况下,充入2 mol SO3与原平衡充入2 mol SO2和1 mol O2为完全等效,此时相当于加压,平衡正向移动,混合物的总物质的量小于原平衡的两倍,平衡时容器内总压强小于原压强的两倍,即小于1.4p,不正确
D:降温,平衡正向移动,不正确
答案为AB
