问题
选择题
0.1mol/L盐酸中水的电离度和由水电离出的[H+]分别为
A.1.8×10-13%、10-13mol/L
B.1.8×10-12%、10-12mol/L
C.1.5×10-13%、10-13mol/L
D.1.8×10-13%、10-12mol/L
答案
答案:A
由上题解法可知[H+]=0.1mol/L。
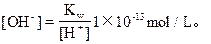
∴由水电离出的[H+]=1×10-13mol/L,
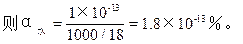
从上题可见,水是极弱的电解质。升温有利于电离,KW值不是一个定值,在利用KW进行换算时,应注明水的温度。水的电离度也同样受温度和溶液酸碱性的影响。酸碱一般都抑制水的电离,使电离度变小,但不管是纯水,还是稀酸、稀碱溶液,由水电离产生的[H+]=[OH-]。这常是解决各类问题的关键。
