问题
填空题
在一固定容积的密闭容器中进行着如下反应: CO2(g) + H2(g) 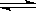 CO(g) + H2O(g) ;其平衡常数K和温度t的关系如下:
CO(g) + H2O(g) ;其平衡常数K和温度t的关系如下:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(2) 该反应的正反应为 反应(“吸热”或“放热”);
(3) 能判断该反应是否已经达到化学平衡状态的是:
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正 = v(H2O)逆 D.c(CO2) = c(CO)
(4) 在850℃时,可逆反应:CO2(g) + H2(g) 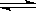 CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
| 时间/min | CO2 (mol/L) | H2 (mol/L) | CO (mol/L) | H2O ( mol/L) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
答案
(1)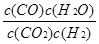 ;(2分) ;(2)放热;(2分)
;(2分) ;(2)放热;(2分)
(3)B、C; (2分,若只选一个对的得1分,全对得2分)
(4)设3min—4min达到平衡时CO、H2O的平衡浓度为c3, 则CO2、H2的平衡浓度分别为0.200-c3和0.300- c3
根据: K= c3·c3/(0.200-c3)·(0.300-c3)= 1 (1分)
c3=0.120mol/L (1分,写0.12的不给分) ;
CO2 (g)的转化率 : 0.120/0.2×100% = 60% (1分)
