问题
判断题
在一定体积的10%的氢氧化钠溶液中滴加10%的盐酸,反应中溶液的温度与加入盐酸的体积变化如下:
| 加入盐酸体积V/Ml | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 测得溶液温度t/ ℃ | 15.2 | 19.6 | 22.0 | 26.0 | 28.2 | 26.7 | 25.7 | 24.7 | 23.7 | 22.9 |
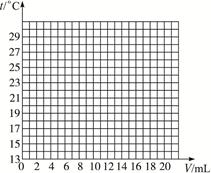
(2)根据曲线讨论溶液温度变化的原因。
①加入盐酸的量在2—10 mL之间时:_____________________________________________;
②加入盐酸的量在10—20 mL之间时:____________________________________________。
(3)若某同学提出“将氢氧化钠固体直接与10%盐酸反应,以探究中和反应是否放热”,此提议是否合理?为什么?
答:__________________________________________________________________________。
答案
(1)

(2)①随盐酸量增加,中和反应放出热量增大,溶液温度上升
②过量盐酸起冷却降温作用,反应停止热量散失
(3)不合理,因为固体氢氧化钠溶于水也要放热
用描点法将表格中的数据在图上表示出来,再连接成曲线。根据图象发现盐酸的量在2—10 mL时,随盐酸量增加,中和反应放出热量增大,溶液温度上升;当盐酸的量在10—20 mL之间,可能是盐酸已经过量,过量盐酸起冷却降温作用。不能用氢氧化钠固体,因为它在溶解过程中也会放热。
