问题
选择题
已知:N2(g)+3H2(g)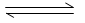 2 NH3(g)△H=-92kJ· mol-1若向体积为10L的恒温密闭容器中充入1.2 mol N2和0.6molH 2反应,由图像分析,下列叙述正确的是
2 NH3(g)△H=-92kJ· mol-1若向体积为10L的恒温密闭容器中充入1.2 mol N2和0.6molH 2反应,由图像分析,下列叙述正确的是
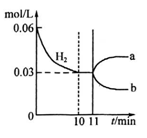
A.10~11min该反应的速率为v(H2)>0.003mol/(L·min)
B.若改变所用催化剂时,△H 会发生变化
C.若将上述密闭容器换作绝热密闭容器,其余条件不变,NH3的产率将降低
D.从11min起其它条件不变,压缩容器的体积,则c(H2 )的变化曲线为b
答案
答案:C
A错,10~11min,氢气的浓度没有变化,相当于反应速率为0
B错,改变所用催化剂,只能影响反应速率,但平衡不影响,即,△H 不会发生变化,
C正确,由于该反应的正反应为放热反应,随反应的进行,容器内温度升高,导致平衡会向逆反应方向移动,即NH3的产率将降低。
D错,从11min起其它条件不变,压缩容器的体积,则c(H2 )的浓度将突然增大,平衡将向正反应方向移动,即c(H2 )的浓度将又会慢慢下降,但不管怎样其浓度最终应比原来高。
