(14分)在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中发生反应:N2O4 (g) 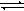 2NO2 (g) △H> 0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化关系如下图所示。
2NO2 (g) △H> 0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化关系如下图所示。
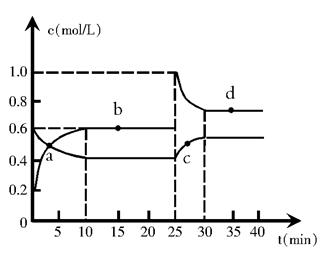
(1)该温度时,该反应的平衡常数为________________, 若温度升高,K值将__________(填“增大”、“减小”或“不变”)。
(2)a、b、c、d四个点中,化学反应处于平衡状态的是____________点。从起点开始首次达到平衡时,以NO2表示的平均反应速率为______________________。
(3)25 min时,增加了______mol___________(填物质的化学式)使平衡发生了移动。
(4)d点对应NO2的物质的量浓度______(填“>”、“<”或“=”)0.8mol•L-1,理由是_____________________________________________________。
(14分)
(1)0.9 (2分) 增大 (2分)
(2)b d (2分) 0.04 mol·L-1·min-1 (2分)
(3)0.8 (1分)NO2 (1分)
(4)< (2分) 假设平衡时二氧化氮的浓度为0.8mol/L时Q="1.58" > K=0.9平衡要向逆向移动,使二氧化氮的浓度降低,所以平衡时二氧化氮的浓度<0.8mol/L. (2分)
