(8分)(2011·扬州调研)在2 L密闭容器中反应2NO2(g) 2NO(g)+O2(g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。请回答下列问题:
2NO(g)+O2(g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。请回答下列问题:
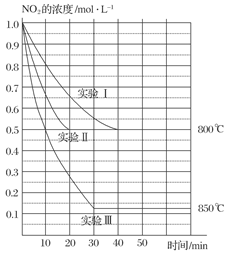
(1)对比实验Ⅰ、Ⅱ和Ⅲ,得出的下列结论中正确的是( )
A.实验Ⅱ和实验Ⅰ相比,可能隐含的反应条件是:反应容器的体积缩小了
B.实验Ⅱ和实验Ⅰ相比,可能隐含的反应条件是:使用效率更高的催化剂
C.实验Ⅰ条件下该反应的平衡常数大于实验Ⅲ条件下该反应的平衡常数
D.对比实验Ⅰ和Ⅲ可知,该反应是吸热反应(2)若实验Ⅰ中NO2的起始浓度改为1.2 mol·L-1,其他条件不变,则达到平衡时所需用的时间________40 min(填“大于”、“等于”或“小于”),NO2的转化率将________(填“增大”、“减小”或“不变”)。
(3)若实验Ⅰ中达平衡后,再向密闭容器中通入2 mol由物质的量之比为1 ∶1组成的NO2与NO混合气体(保持温度不变),则平衡将________移动,新平衡状态时NO2的物质的量浓度为________mol·L-1。
(4)若将实验Ⅲ所得的平衡混合气体通入足量的水中,欲使气体被完全吸收则至少应同时通入标准状况下的空气________L。(设空气中N2与O2体积比4 ∶1)
(1)BD (2)小于减小(3)不 1.0 (4)56
(1)Ⅱ比Ⅰ达到平衡所需时间短,是因为使用了催化剂。而Ⅰ的平衡浓度大于Ⅲ的,则K1<K3,而温度升高NO2转化率增加,因而该反应为吸热反应。
(2)增大反应物浓度,反应速率加快,NO2转化率降低。
(3)由平衡常数可知,K=因为c(NO)=c(NO2),而c(O2)没变,平衡不移动。
(4)Ⅲ的平衡混合气体就相当于起始2 mol NO2气体所需V空气=5V(O2)=5×V(NO2)=5××2×22.4 L=56 L。
