一定温度下,可逆反应A(s)+2B(g)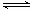 2C(g)+D(g);△H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。
2C(g)+D(g);△H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。
下列说法正确的是
A.保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
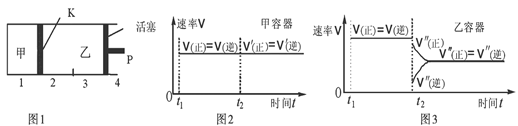
B.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
C.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
D.保持活塞位置不变,改变温度,达到新的平衡后,甲、乙中B的体积分数均增大
答案:B
A错,t1时两容器内均达到平衡状态时两容器内各组分的浓度完全相同,当在甲中再加入1 mol A和2 mol B后,相当于在将乙的容器压缩为原来的一半,则平衡将向逆反应方向移动,达到新的平衡后,甲中C的浓度小于乙中C的浓度的2倍;B正确;C错,保持温度不变,移动活塞P,使乙的容积和甲相等,在这个瞬间,乙中C的体积分数是甲中C的体积分数的2倍,随后平衡将向逆反应方向移动,达到新的平衡时,乙中C的体积分数小于甲中C的体积分数的2倍;D错,改变温度不清楚是升高温度还是降低温度;无法判断;
