定温度、压强和有铁触媒的条件下,在密闭容器中充入N2、H2和NH3 。若起始时n(N2)="x" mol、n(H2)="y" mol、n(NH3)="z" mol (x、y、z均不为0 ),平衡时,n(N2)=0.1mol、n(H2)=0.3mol、n(NH3)=0.08mol。下列有关判断不合理的是( )
A.x : y ="1" : 3
B.N2、H2的转化率不相等
C.平衡时,H2与NH3的生成速率之比为3 : 2
D.x的取值范围为0<x<0.14
答案:B
A、依据B选项分析可知,反应物的起始量之比为1:3,即x:y=1:3,故A正确;
B、题干中平衡时氮气和氢气物质的量之比为1:3,转化量是依据化学方程式计量数的计算剩余转化量氮气和氢气物质的量之比等于1:3,根据平衡起始量-变化量=平衡量,可知,氮气和氢气转化率相同,故B错误;
C、反应过程中和平衡状态下化学反应中物质反应速率之比等于化学方程式的计量数之比,平衡时,H2与NH3的生成速率之比为3:2,故C正确;
D、依据极值转化始转平,平转始,得到氮气的物质的量取值范围,假设反应正向进行
N2+3H2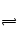 2NH3
2NH3
起始量(mol) x y z
变化量(mol) x-0.1 y-0.3 0.08-z
平衡量(mol) 0.1 0.3 0.08
若正向进行彻底,氮气物质的量全部转化,物质的量为0;若反应逆向进行彻底,氮气物质的量为0.14mol,氨气为0,但反应是可逆反应不可能进行彻底,得到氮气的物质的量为
0<n(N2)<0.14mol,故D正确;
故选B.
