问题
填空题
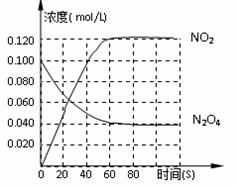
在一体积为1L的容器中,通入一定量的N2O4,在100℃时发生如下反应,N2O4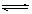 2NO2–Q(Q>0),其N2O4和NO2浓度变化如图如示。
2NO2–Q(Q>0),其N2O4和NO2浓度变化如图如示。
(1)上述反应的平衡常数表达式为______________,升高温度K值_______(填“增大”、“减小”或“不变”)
(2)在0-60s这段时间内,四氧化二氮的平均反应速率为________mol/L.s
(3)120℃时,在相同的容器中发生上述反应,容器内各物质的物质的量变化如图:
|
①该温度时,反应处于平衡状态的时间是____________,C1的数值_____0.04(填“大于”、“小于”或“等于”。
②反应在60-8 0s间平衡向逆反应方向移动,可能的原因是( )
0s间平衡向逆反应方向移动,可能的原因是( )
(A)使用催化剂 (B)减少N2O4的浓度
(C)减小体系压强 (D)增加NO2的浓度
答案

