问题
选择题
N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g) 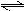 4NO2(g)+ O2(g);△H >0,T1温度下的部分实验数据如下表.下列说法不正确的是
4NO2(g)+ O2(g);△H >0,T1温度下的部分实验数据如下表.下列说法不正确的是
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
B.T1温度下的平衡常数为K1 =125,1000s时转化率为50%
C.其他条件不变时,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol/L,则T1 <T2
D.T1温度下的平衡常数为K1 ,T3温度下的平衡常数为K3,若K1> K3,则T1>T3
答案
答案:C
2N2O5(g) 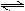 4NO2(g)+ O2(g)
4NO2(g)+ O2(g)
起始浓度5.00 0 0
变化浓度1.48 2.96 0.74
500s浓度3.52
所以,500s内N2O5分解速率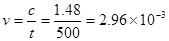 A正确
A正确
T1温度下1000s时转化率若为50%则
根据方程式:2N2O5(g) 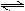 4NO2(g)+ O2(g),
4NO2(g)+ O2(g),
起始浓度 5.00 0 0
变化浓度 2.50 5.00 1.25
平衡浓度 2.50 5.00 1.25
则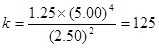 ,即B正确
,即B正确
其他条件不变时,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol/L,,比T1温度下浓度高,则说明在温度为T2时,平衡向逆反应方向移动,因正反应方向为吸热反应,所以降温平衡将向放热反应即逆反应移动,C错
同理也可分析知D正确;
