问题
填空题
(12分)在100 ℃时,将0.40 mol二氧化氮气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
⑵此条件下该反应的化学平衡常数的值约为___________(保留两位有效数字)。
⑶若达到平衡后,降低温度,气体颜色会变浅,则该反应的平衡常数将____________(填“增大”、“减小”或“不变”)。
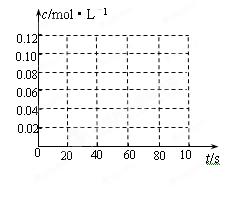
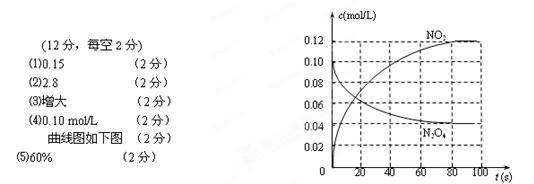
⑷若在相同情况下最初向该容器中充入的是N2O4气体,要达到初始数据表中同样的平衡状态,N2O4的起始浓度是_______________;假设在80 s时达到平衡,请在右图中画出并标明该条件下此反应中N2O4和NO2的浓度随时间变化的曲线。
⑸计算⑷中条件下达到平衡后N2O4的转化率__________________。
答案