问题
填空题
(8分)室温下,将1.00mol/L盐酸滴入20.00mL 1.00mol/L氨水中,溶液pH和温度(0C)
随加入盐酸体积变化曲线如右图所示。
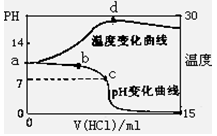
(1)下列有关说法正确的是___________
A.a点由水电离出的C(H+)=10-14mol/L
B.b点: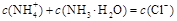
C.c点:C(Cl-)=C(NH4+)
D.d点后,容易温度略下降的主要原因是NH3·H2O电离吸热
(2)在滴加过程中,水的电离程度的变化是先 后 (填“增大”、“减小”或“不变”);
(3)在下表中,分别讨论了上述实验过程中离子浓度的大小顺序,对应溶质的化学式和
溶液的pH。试填写表中空白:
| 离子浓度的关系 | 溶质 | 溶液的pH | 物料守恒关系 | |
| ① | C(NH4+)>C(Cl-)>C(OH-)>C(H+) | pH>7 | / | |
| ② | NH4Cl | / | ||
| ③ | C(Cl-)>C(H+)>C(NH4+)>C(OH-) | pH<7 | / |
答案
(1)C(2分)
(2)增大(1分) 减小 (1分)
(3)①NH4Cl、NH3·H2O (1分)
②C(Cl-)>C(NH4+)>C(H+)>C(OH-)(1分)
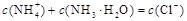 =0.5mol/L(1分)
=0.5mol/L(1分)
③NH4Cl、HCl (1分)
