某温度(T℃)时,测得0.01mol/LNaOH溶液的pH为11,则该温度下水的KW=____________。则该温度________(填“大于”、“小于”或“等于”)室温,其理由是_______________________________________________________________________。
此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合,通过计算填写以下不同情况时两溶液的体积比:
(1)若所得混合溶液为中性,且a=12,b=2,则Va∶Vb=________。
(2)若所得混合溶液为中性,且a+b=12,则Va∶Vb=________。
(3)若所得混合溶液的pH=10,且a=12,b=2,则Va∶Vb=__________。
1.0×10-13 大于 水的电离是吸热的,升温时水的电离平衡正向移动,KW增大,因该温度下的KW比25℃时大,所以该温度大于25℃
(1)1∶10 (2)10∶1 (3)1∶9
0.01mol/LNaOH溶液中c(OH—)=0.01mol/L,pH=11,即c(H+)=10—11mol/L,KW=c(OH—)·c(H+)=1.0×10-13
若所得混合溶液为中性,则c(OH—)= c(H+),即:
10a-13·Va = 10-b·Vb 代入a、b即可求出答案。
若所得混合溶液的pH=10>13/2,则为碱性,则:
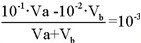 可得答案。
可得答案。