(8分)硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:
H2SO4=H++HSO4—, HSO4  H++SO42—。
H++SO42—。
请回答下列有关问题:
(1)Na2SO4溶液呈 填“弱酸性”、“中性”或“弱酸性”);
(2)H2SO4溶液与BaCl2溶液反应的离子方程式为 ;
(3)在0.10mol·L—1的Na2SO4溶液中,下列离子浓度关系正确的是 (填写编号)
A.c(Na+)=c(SO42—)+c(HSO4—)+c(H2SO4)
B.c(OH—)=c(HSO4—)+c(H+)
C.c(Na+)+c(H+)=c(OH—)+c(HSO4—)+2c(SO42—)
D.c(Na+)="2" c(SO42—)+2 c(HSO4—)(4)写出NaHSO4溶液中溶质电离常数(Ka)的表达式 ;
(1)弱碱性;(2)HSO4—+Ba2+ = BaSO4↓+H+(3)B、C、D
(4)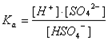
(1)SO42―+H2O HSO4―+OH― ,水解后呈弱碱性;(2)HSO4—+Ba2+= BaSO4↓+H+(3)A、不正确,溶液中没有H2SO4分子,B、C、D正确,B、质子守恒,C、电荷守恒,D、物料守恒
HSO4―+OH― ,水解后呈弱碱性;(2)HSO4—+Ba2+= BaSO4↓+H+(3)A、不正确,溶液中没有H2SO4分子,B、C、D正确,B、质子守恒,C、电荷守恒,D、物料守恒
(4)