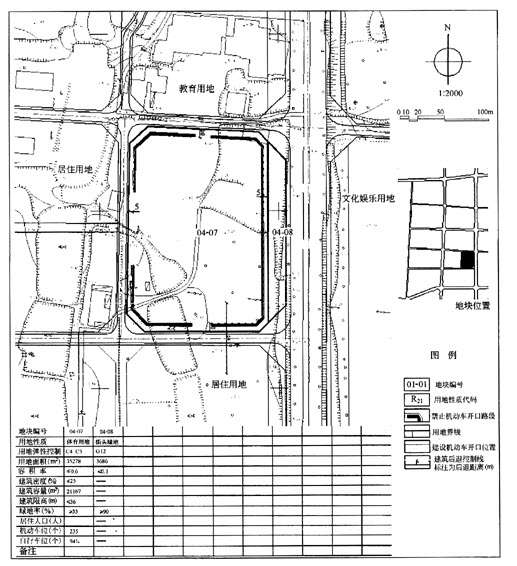
一定条件下,体积为2L的密闭容器中,1mol A和1mo1 B进行反应:
A(g)+3B(g)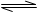 2C(g) 经2分钟反应达到平衡,此时生成0.2mol C。
2C(g) 经2分钟反应达到平衡,此时生成0.2mol C。
下列说法正确的是 ( )
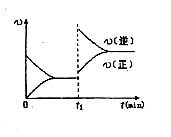
A.反应开始至2分钟时,以B浓度变化表示的反应速率为0.05mol/(L.min)
B.反应开始至2分钟时,A的转化率为5%
C.若其他条件不变,升高温度,A的体积分数增大,则该反应的△H<0
D.若其他条件不变,增大压强,化学反应速率的变化符合右侧示意图
答案:C
解本题学生应明确化学反应速率的基本公式V=△C÷△t 和化学反应速率的表示规律;外在条件对化学平衡移动方向的影响。
知有反应 A(g)+3B(g)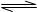 2C(g)
2C(g)
始 1 2 0 mol
2分钟末 1-0.1 2-0.3 0.2 mol
变化 0.1 0.3 0.2 mol
A应为:V(B)=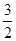 V(C)=
V(C)= 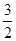 ×(0.2÷2)÷2 =" 0.075" mol.L-1.min-1
×(0.2÷2)÷2 =" 0.075" mol.L-1.min-1
B应为:2分钟末A的转化率为 = 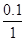
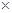 100% =" 10%"
100% =" 10%"
C:正确。升高温度从图中可见:逆反应速率增大的倍数大于正反应速率增大的倍数,平衡向逆反应方向移动,即逆反应吸热,正反应放热。
D:错误,本反应反应物气体系数和为4,生成物气体系数为2,增大压强平衡向气体体积减小的方向移动。应为,正反应速率增大的倍数大于逆反应速率增大的倍数。