(12分)在一固定容积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g);△H=" Q" KJ/mol其化学平衡常数K和温度t的关系如下:
CO(g)+H2O(g);△H=" Q" KJ/mol其化学平衡常数K和温度t的关系如下:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)上述反应中Q 0 (选填“>”或“<”)
(2)能判断该反应已达到化学平衡状态的依据是 。
a. 容器中压强不变 b. 反应热不变 c. v正(H2) =v逆(CO) d. CO2的质量分数不变
(3)温度为850℃时,可逆反应CO(g)+H2O(g) CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内物质的浓度变化如下表:
CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内物质的浓度变化如下表:
850℃时物质的浓度(mol/L)的变化
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c 2 | c 3 | c 3 |
| 4 | c 1 | c 2 | c 3 | c 3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
②反应在4min~5min之间,平衡向逆反应方向移动,可能的原因是 表中5min~6min之间数值发生变化,可能的原因是
a . 增加水蒸气 b. 降低温度 c. 使用催化剂 d. 增加氢气浓度
(1)> (2) c d (3) 0.08 40% (4) d a
(1)由表中数据,随温度的升高,K增大,即该反应的正反应方向为吸热反应,Q>0;
(2)能判断该反应已达到化学平衡状态的依据是:cd;a错,该反应为等体积反应,无论平衡与否容器内压强不变;b错,对于某一具体的反应来说,反应热为一常数;
(3)①3 min时该反应已达平衡则,
由化学反应方程式CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度(mol/L) 0.200 0.300 0 0
变化浓度(mol/L) x x x x
平衡浓度(mol/L)0.2—x 0.3—x x x
850℃时该反应的平衡常数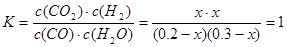 ,解得x=0.12;
,解得x=0.12;
即可得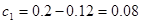 ;H2O (g)的转化率
;H2O (g)的转化率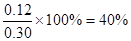 ;
;
②反应在4min~5min之间,平衡向逆反应方向移动,可能的原因是增加氢气浓度,表中5min~6min之间数值发生变化,可能的原因是增加水蒸气;
