问题
填空题
(9分)(1)已知:N N的键能是946 kJ/mol,H—H的键能为436 kJ/mol,N—H的键能为391 kJ/mol,请据此写出合成氨反应的热化学方程式 ;
N的键能是946 kJ/mol,H—H的键能为436 kJ/mol,N—H的键能为391 kJ/mol,请据此写出合成氨反应的热化学方程式 ;
该反应的熵变△S 0(填“>”、“<”或“=”)。
(2)将1 mol N2与3 mol H2混合置于容积为10 L的密闭容器中。
①温度为T1时,混合气体中氨的物质的量分数为25%,则N2的转化率为 。
②当温度由T1变化到T2 (T2 >T1)时(如图),平衡常数KA KB(填“>”、“<”或“=”)。
③温度在T1时,若起始时向10L密闭容器中加入N2 0.5 mol、H2 1.5 mol、NH3 1 mol。当反应达到平衡时,与起始时比较, (填化学式)的物质的量增加。
答案
(1)N2(g) +3H2(g) 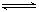 2NH3(g) △H= - 92 kJ/mol (2分) < (1分)
2NH3(g) △H= - 92 kJ/mol (2分) < (1分)
(2)① 40% (2分) ② > (2分)
(3)N2 、H2 (2分)
