某校化学实验小组同学进行有关NO2气体的系列实验。
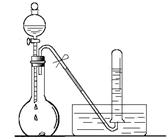
(1)如上图所示,烧瓶中放有少量铜片,打开分液漏斗的旋塞,加入过量浓硝酸,烧瓶中产生气体的颜色是 ,试管中收集的气体颜色是 ,用化学方程式表示其原因 ;
(2)将烧瓶浸入冰水中,烧瓶内气体颜色 (填“变深”、“不变”或“变浅”),使用化学用语和必要的文字说明颜色变化的原因 ;
(3)在80℃时,将0.40 mol N2O4气体充入2 L已经抽空的固定容积的密闭容器中发生反应,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4)/mol | 0.40 | a | 0.20 | c | d | e |
| n(NO2)/mol | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
②平衡后,向该容器中再充入0.2molN2O4气体,则N2O4的转化率 (填增大、减小或不变)
③改变条件使反应重新达到平衡,能使c(NO2)/c(N2O4)值变小的措施有(填序号) 。
A.增大N2O4的起始浓度 B.升高温度
C.使用高效催化剂 D.向混合气体中通入稀有气体
(11分)
(1)红棕色( 1分)无色( 1分)
Cu + 4HNO3 (浓)===Cu(NO3)2 + 2NO2↑+ 2H2O ( 1分)
3NO2 + H2O===2HNO3 + NO ( 1分)
(2)变浅(1分), 2NO2 N2O4 ΔH<0 ,温度降低,平衡向正反应方向移动,c(NO2)浓度降低(2分)
N2O4 ΔH<0 ,温度降低,平衡向正反应方向移动,c(NO2)浓度降低(2分)
(3)① a="0.28" (1分), 1.8 (1分), ②减小(1分) ③ A (1分)
(1)烧瓶内发生的反应为:Cu + 4HNO3 (浓)===Cu(NO3)2 + 2NO2↑+ 2H2O,得到红棕色的气体NO2;
用排水法收集时发生反应:3NO2 + H2O===2HNO3 + NO,故在试管中收集到的气体为无色的NO
(2)由于存在可逆反应:2NO2 N2O4 ΔH<0,故将烧瓶浸入冰水中,相当于降温,平衡正向移动,c(NO2)浓度降低,混合气体的颜色变浅;
N2O4 ΔH<0,故将烧瓶浸入冰水中,相当于降温,平衡正向移动,c(NO2)浓度降低,混合气体的颜色变浅;
(3)反应:N2O4 2NO2
2NO2
初n: 0.4 0
20s: 0.28 0.24
80s: 0.1 0.6
①可见a=0.28,在80s时反应达到平衡,K=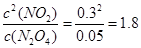
②平衡后,向该容器中再充入N2O4气体,相当于加压,平衡N2O4 2NO2左移,则N2O4的转化率减小
2NO2左移,则N2O4的转化率减小
③A.增大N2O4的起始浓度,相当于加压,平衡左移,c(NO2)/c(N2O4)值变小,符合题意
B.升高温度,平衡正向移动,排除
C.使用高效催化剂,不会影响平衡移动,排除
D.向混合气体中通入稀有气体,各物质浓度不变,平衡不移动,排除
选A
