(共12分)在容积固定为2L的密闭容器中,充入0.180 molHI,480℃时反应:
2HI(g)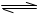 H2(g)+I2(g),体系中n(HI)随时间变化情况如下表:
H2(g)+I2(g),体系中n(HI)随时间变化情况如下表:
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| n(HI)/mol | 0.180 | 0.164 | 0.152 | 0.144 | 0.140 | 0.140 |
(1)0~2min内H2的平均反应速度为 。达平衡时,HI的转化率是_________。(2)上述正向反应是: 反应(选填:放热、吸热)。
(3)某温度下上述反应平衡时,恒容、升高温度,原化学平衡向 反应方向移动(填“正”或“逆”),正反应速率 (填“增大”、“减小”或“不变”),容器内混合气体的压强 (填“增大”、“减小”或“不变”)。
(4)480℃时,反应H2(g)+I2(g)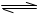 2HI(g)的平衡常数K的值为 。
2HI(g)的平衡常数K的值为 。
(5)要增大反应2HI(g)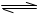 H2(g)+I2(g)的平衡常数,可采取的措施是 (选填字母)。
H2(g)+I2(g)的平衡常数,可采取的措施是 (选填字母)。
A.增大HI起始浓度
B.向混合气体中通入I2
C.使用高效催化剂
D.升高温度
(1)0.002mol/(L·min),22.2% (2)吸热
(3)正,增大,增大。 (4)1/49 5)D
(1)0~2min内HI的速率为 0.004mol/(L·min),由各物质的系数比可推出,
0.004mol/(L·min),由各物质的系数比可推出, 0.002mol/(L·min);
0.002mol/(L·min);
由表格中数据可知,反应到8分钟时,HI的浓度不再改变,即反应已经达到平衡,此时HI的转化率为 =22.2%
=22.2%
(2)由题意知,可逆反应2HI(g) H2(g)+I2(g)降温时碘蒸气浓度减小,平衡左移,正反应为吸热反应
H2(g)+I2(g)降温时碘蒸气浓度减小,平衡左移,正反应为吸热反应
(3)升温时,平衡向吸热反应方向移动,即正向移动;正逆反应速率均增大;由于两边气体系数相等,混合气体的总物质的量并不改变,但温度升高,由PV=nRT可知,压强增大
(4)由平衡常数的定义可知,在480℃时,K= 1/49
1/49
(5)K只与温度有关,升温平衡右移,K增大,故答案为D
