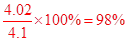⑴ 准确称取烧碱样品4.1g,将样品配成250mL的待测液,需要的仪器有托盘天平、小烧杯、量筒、玻璃棒、 、 。(填仪器)
⑵ 用 (“碱式”或“酸式”)滴定管量取10.00mL待测液注入锥形瓶中。
⑶若锥形瓶用蒸馏水洗涤后,水未倒尽,则测得样品中烧碱的质量分数________(填“偏高”、“偏低”或“无影响”)。
⑷若滴定到达终点时,仰视读出滴定管读数;则测得样品中烧碱的质量分数________ (填“偏高”、“偏低”或“无影响”)。
⑸滴定时边滴边摇动锥形瓶,眼睛应观察______。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
⑹滴定达到终点时的现象 。
⑺ 根据下列测定数据,分析得到合理数据,计算待测烧碱溶液的浓度: 。
| 滴定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 第三次 | 10.00 | 5.70 | 25.70 |
(12分)(6、7、8每空2分,其余1分)
⑴ 250mL容量瓶,胶头滴管
⑵ 碱式 ⑶无影响 ⑷偏低 ⑸B
⑹溶液恰好由红色变无色,且半分钟内不褪色
⑺ c(NaOH)=0.4020mol/L ⑻98%
本题考查了中和滴定的基本操作,它也是一个定量实验,一般通过多次测量求平均值的方法进行测定。
(7)三次所耗标准液的体积平均值为:20.00ml,而NaOH溶液为10.00ml,故c(NaOH)=0.4020mol/L,进而求出m(NaOH)="4.020" g,则样品的纯度为: