(8分)已知25℃时几种物质的电离度(溶液浓度均为0.1mol/L) 如下表(已知硫酸的第一步电离是完全的):
| ①硫酸溶液 | ②硫酸氢钠溶液 | ③醋酸溶液 | ④盐酸 |
HSO4-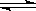 H++SO42— H++SO42— | HSO4-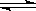 H++SO42- H++SO42- | CH3COOH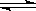 CH3COO-+H+ CH3COO-+H+ | HCl = H++Cl- |
| 10℅ | 29℅ | 1.33℅ | 100℅ |
⑵25℃时,0.1mol/L上述几种溶液中C(H+)由大到小的顺序是 (填序号,下同);
⑶25℃时,将足量锌粉放入等体积pH=1的上述几种溶液中,产生H2的体积(相同状况)由大到小的顺序是 ;
⑷25℃时,0.1mol/L H2SO4中的HSO4-的电离度小于0.1mol/L NaHSO4中HSO4-的电离度的原因是:
(1)H++HSO4-+Ba2+ +2OH-=BaSO4↓+2H2O (2)①④②③
(3)③②①④ (4)硫酸的一次电离抑制了HSO4-的电离
(1)根据已知信息可知,硫酸的第二步电离存在电离平衡,所以和氢氧化钡反应的方程式为H++HSO4-+Ba2+ +2OH-=BaSO4↓+2H2O。
(2)硫酸的第二步电离的电离度是10%,所以硫酸溶液中氢离子的浓度为0.1mol/L+0.1mol/L×10%=0.11mol/L。盐酸全部电离,氢离子浓度是0.1mol./L。磷酸氢钠溶液中HSO4-的电离度是29%,所以氢离子浓度为0.1mol/L×0.29=0.029mol/L。醋酸的电离度是1.33%,所以氢离子浓度是1.33%×0.1mol/L=0.00133mol/L,所以大小顺序为①④②③。
(3)酸越弱,当pH相等时,相应物质的浓度就越大,即醋酸的浓度大于磷酸氢钠的浓度。因为硫酸是二元酸,盐酸是一元强酸,因此当pH相同时,硫酸最终提供的氢离子要多于盐酸中的氢离子,所以大小顺序为③②①④。
(4)HSO4-能电离出氢离子,而硫酸第一步完全电离,生成的氢离子,可抑制HSO4-能电离。
