问题
计算题
(8分)某温度(t℃)时,水的KW=10-13,则该温度(填大于、等于或小于)
(1)_____25℃,理由是_________________________________________________,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,
(2)若所得混合溶液为中性,则a:b=_________;
(3)若所得混合溶液pH=2,则a:b=__________。
答案
(1)大于;水的电离吸热,升高温度,促进水的电离,KW增大
(2)10:1 (3)2:9
(1)25℃时水的离子积常数是10-14,如果水的KW=10-13,则温度一定大于25℃.因为电离是吸热的,所以加热促进水的电离,离子积常数增大。
(2)此温度下pH=11的NaOH溶液的浓度是0.01mol/L。所得混合溶液为中性,说明氢离子的物质的量和OH-物质的量相等,即a×10-2=b×10-1,解得a︰b=10︰1。
(3)所得混合溶液pH=2,说明硫酸是过量的,因此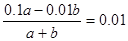 ,解得a︰b=2︰9。
,解得a︰b=2︰9。
