二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上利用煤的汽化产物(水煤气)合成二甲醚。
请回答下列问题:
(1)煤的汽化的主要化学方程式为 。
(2)利用水煤气合成二甲醚的总反应式可表示为3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) △H< 0。一定条件下得密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
CH3OCH3(g)+CO2(g) △H< 0。一定条件下得密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
A.高温高压
B.加入催化剂
C.减少CO2的浓度
D.增加CO的浓度 E.分离出二甲醚(3)已知反应2CH3OH(g)  CH3OCH3(g)+H2O(g),某温度下得平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g),某温度下得平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol/L) | 0.44 | 0.6 | 0.6 |
②若加入CH3OH后,经10min反应达到平衡,试计算此时CH3OH的物质的量浓度和该时间内CH3OH的化学反应速率?
(10分)
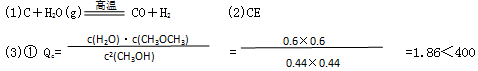
向正方向进行, v(正) > v(逆)
② 2CH3OH(g)  CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
始态(mol/L) c0 0 0
某时刻 0.44 0.6 0.6
z左边倒 0.44+1.2 0 0 c(CH3OH)=0.44+1.2=1.64mol/L
到平衡反应浓度 △c △c/2 △c/2
平衡浓度 0.44-△c △c/2 △c/2

△c ="1.6mol/L " 平衡,时CH3OH的物质的量浓度 0.04mol/L
该时间内CH3OH的化学反应速率为0.16mol/(L·min)
