(7分)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g) CO2(g)+H2(g) △H<0试回答下列问题:
CO2(g)+H2(g) △H<0试回答下列问题:
(1)若起始时c(CO)=2mol·L-1,c(H2O)=3mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K= 。
(2)在相同温度下,若起始时c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”),此时v(正) v(逆)(填“大于”“小于”或“等于”),你判断的依据是 。
(3)若降低温度,该反应的K值将 ,该反应的化学反应速率将 (均填“增大”“减小”或“不变”)。
(7分)(1)1 (2)否、大于 因为
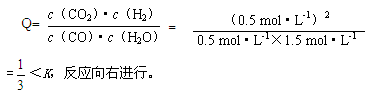
(3)增大 减小
(1)依据平衡计算的三步法,可推知在平衡时CO的浓度为0.8mol/L,H2O浓度为1.8mol/L,CO2浓度为1.2mol/L,H2的浓度为1.2mol/L.再根据K值计算公式得到:K=1.
(2)以0.5mol/LH2来计算,K值是小于1的,所以没有达到平衡状态,由于K值小于1,那说明产物的浓度还需要提高,反应还应朝正方向进行,V正〉V逆.
(3)该反应是一个放热反应,降低温度,平衡正向移动,生成物浓度升高,反应物浓度降低,K值变大.但是降低温度会使分子运动速率减慢,化学反应速率也会减小.
