问题
实验题
(6分)(1)某学生进行中和热测定,取用50 mL 0.50 mol·L-1的HCl和50 mL 0.55 mol·L-1的NaOH溶液(密度都是1 g·cm-3)。实验后得到以下数据:
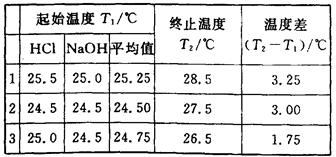
(中和后生成的溶液的比热容为4.18J·g-1·℃-1)请替该同学计算出中和热的平均值: .
(2)该学生测得的数据比理论值 (填“高”或“低”).
(3)从下列分析中选出该学生产生实验误差的原因可能是(填写字母) .
A.溶液混合后未及时盖好量热计杯盖
B.倾倒溶液太快,有少量溅出烧杯
C.溶液混合后搅拌不够
D.未等温度升到最高值就记录温度计示数E.用量筒量取盐酸体积时仰视读数
F.烧杯和玻璃棒吸收了一部分热量
答案
(1)52.25kJ·mol-1 (2)低 (3)ABCDF
(1)根据实验数据可知,实验3中数据是无效的,所以温度差的平均值是3.125℃,所以根据△H=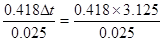 =52.25kJ·mol-1。
=52.25kJ·mol-1。
(2)中和热是57.3kJ·mol-1,所以实验值比理论值低。
(3)数值偏低,说明反应中有热量损失,或者是酸、碱有损失。E中读数偏大,结果应该是是偏高,所以正确的答案选ABCDF。
