在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol·L-1,c(B)="0.200" mol·L-1,c(C)="0" mol·L-1。反应物A的浓度随时间的变化如右图所示。下列说法正确的是 ( )
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol·L-1,c(B)="0.200" mol·L-1,c(C)="0" mol·L-1。反应物A的浓度随时间的变化如右图所示。下列说法正确的是 ( )
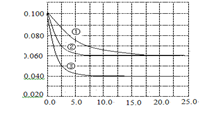
A.反应A+2B C的△H>0
C的△H>0
B.若反应①、②的平衡常数分别为K1、K2,则K1< K2
C.实验②平衡时B的转化率为60%
D.减小反应③的压强,可以使平衡时c(A)="0.060" mol·L-1
答案:A
与①比较,②到达平衡的时间缩短,但A的浓度没变,平衡没动,所以②为使用催化剂的情况。温度没有改变,所以②与①的平衡常数相同,B错。平衡时A的浓度为0.060 mol·L-1,所以A转化了0.040 mol·L-1,则B转化0.080 mol·L-1,转化率为0.080/0.200*100%=40%,C错。③与①比较,到达平衡的时间缩短,A的浓度减小,说明反应速率加快,平衡正向移动了,因为是在溶液中进行的反应,各物质的起始浓度又相同,所以该情况是由升高温度导致的。则推出正反应吸热,△H>0,A对。减小反应③的压强,A的浓度会瞬间减小,平衡逆向移动,但根据勒夏特列原理,A的浓度减小就是减小了,平衡移动只是减弱了“A的浓度减小”的程度, D错。故选A