(21分)(1)用50mL 0.55mol/L NaOH溶液和50mL 0.25mol/L H2SO4溶液来做中和热测定的实验,测得溶液在反应前后的温度变化为t1℃~t2℃(t2>t1),混合后溶液的比热容为c = 4.18J/(g·℃),溶液的密度都近似为1g/mL,中和热△H=__________(填表达式,不用化简);若将H2SO4溶液换成相同物质的量浓度的CH3COOH溶液,测得的△H______填(“偏大”、“偏小”或“相同”);若将稀硫酸换成浓硫酸来做该实验,测得的△H_______(填“偏大”、“偏小”或“相同”)。
(2)某高能化学物质N2H2内,氮元素的杂化类型为____,电子式为____,一个分子中有σ键 个 ,π 键 个。
(3).在密闭容器中进行可逆反应: CO(g)+NO2(g)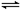 CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
①增大容器的体积,平衡 移动(填“正向”“逆向”“不”),反应混合物的颜色 。(填“变深”“变浅”“不变”)
②容器体积不变:若通人CO2气体,平衡 移动,反应混合物的颜色 。若通人N2气体,平衡 移动,反应混合物的颜色 。③加入催化剂,平衡 移动。
(4)下表是几种常用燃料(1 mol)完全燃烧时放出的热量:
| 物质 | 炭粉(C) | 一氧化碳(CO) | 氢气(H2) | 甲烷(CH4) | 乙醇(C2H5OH) |
| 状态 | 固体 | 气体 | 气体 | 气体 | 液体 |
| 热量(kJ) | 392.8 | 282.6 | 285.8 | 890.3 | 1 367 |
②写出管道煤气中的一氧化碳燃烧热的热化学方程式_______________________
③充分燃烧1 mol表中各种燃料,排放出二氧化碳的量最多的是________。
④矿物燃料储量有限,而且在燃烧过程中会产生污染。根据能源多样化的发展战略,我国开发利用的绿色能源有________等。
(21分)(1)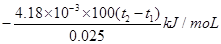 偏大 偏小(各2分)
偏大 偏小(各2分)
(2)sp2杂化 3 1 (各1分)
(3)不,变浅 逆向 变深 不 不变 (各1分)
(4)(1)甲烷(1分) (2)CO(g)+1/2O2(g)===CO2(g) ΔH=-282.6 kJ·mol-1
(2分)
(3)乙醇(1分) (4)氢能、太阳能(或风能、地热能)(1分)
(1)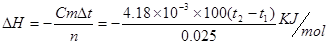 ,CH3COOH为弱酸,在与NaOH溶液反应的过程中存在弱酸的电离,而电离吸热,放出的热量有一部分被吸收,所以放出的热量减少,但由于焓变前面有一个负号所得测得的焓变偏大,若将稀硫酸换成浓硫酸,由于浓硫酸稀释过程中会放热,所以放出的热量会增大,焓变前有一个负号所以测得的焓变偏小。
,CH3COOH为弱酸,在与NaOH溶液反应的过程中存在弱酸的电离,而电离吸热,放出的热量有一部分被吸收,所以放出的热量减少,但由于焓变前面有一个负号所得测得的焓变偏大,若将稀硫酸换成浓硫酸,由于浓硫酸稀释过程中会放热,所以放出的热量会增大,焓变前有一个负号所以测得的焓变偏小。
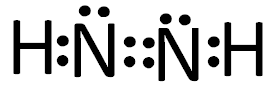
(2)每个N原子周围有5个电子,再加上氢原子的一个电子,每个N原子周围有6个电子,可以形成3对电子对,所以结合分子的结构可判断N采取的杂化方式为sp2杂化,电子式为

,由电子式可知1个分子中有3个σ键 ,1个π 键。
(3)①增大容积,相当于减小压强,平衡向体积增大的方向移动,但是该反应前后体积没有发生变化,所以增大容积该平衡不发生移动,但是由于增大容积二氧化氮的浓度的减小,所以颜色变淡。②通入CO2气体,CO2的浓度增大平衡向逆向移动,反应混合物的颜色变深,若通人N2气体,平衡体系的压强增大但平衡不发生移动反应混合物的颜色不变。③催化剂对平衡无影响所以加入催化剂,平衡不移动。
(4)①从热量角度分析,等量的气体燃料甲烷燃烧放出的热量最多,所以此题填甲烷;
②一氧化碳燃烧热的热化学方程式CO(g)+1/2O2(g)===CO2(g) ΔH=-282.6 kJ·mol-1
③充分燃烧1 mol表中各种燃料产生的二氧化碳的量炭粉(C)、一氧化碳(CO)、甲烷(CH4)都是1mol,氢气为0,乙醇为2mol,所以产生二氧化碳最多的是乙醇。
④绿色能源有太阳能、风能、氢能、潮汐能、地热能。
