问题
选择题
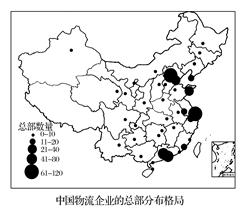
将一定量的Ag2SO4固体置于容积不变的容器中,在某温度下发生下列反应:
Ag2SO4(s)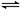 Ag2O(s)+SO3(g),2SO3(g)
Ag2O(s)+SO3(g),2SO3(g)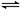 2SO2(g)+O2(g),经十分钟后,反应达到平衡,此时C(SO3)=0.4 mol/L,C(SO2)=0.1 mol/L,则下列叙述不正确的是
2SO2(g)+O2(g),经十分钟后,反应达到平衡,此时C(SO3)=0.4 mol/L,C(SO2)=0.1 mol/L,则下列叙述不正确的是
A.SO3的分解率为20%
B.平衡时,v(O2)=0.005 mol/(L·min)
C.容器内气体的密度为40g/L
D.加压,容器内固体质量不变
答案
答案:D
假设容器的容积为1L,容器内的SO2来SO3自的分解,根据方程式可知要生成SO2=0.1 mol,需要发生分解的SO3的0.1 mol,平衡时容器内的SO3有0.4mol,所以硫酸银分解生成的SO3总共有0.1+0.4="0.5mol," SO3的分解率为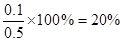 ,A正确,不选;平衡时
,A正确,不选;平衡时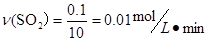 根据速率之比等于计量数之比可以得到v(O2)=
根据速率之比等于计量数之比可以得到v(O2)= 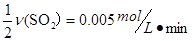 ,B正确,不选;根据方程式可知反应生成的氧气的物质的量为0.1mol,容器内气体的密度为
,B正确,不选;根据方程式可知反应生成的氧气的物质的量为0.1mol,容器内气体的密度为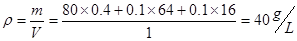 ,增大压强,两个化学平衡均向逆向移动,第一个平衡逆向移动,会导致固体的质量增大,气体质量减小,所以D错误,答案选D.
,增大压强,两个化学平衡均向逆向移动,第一个平衡逆向移动,会导致固体的质量增大,气体质量减小,所以D错误,答案选D.