已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.0kJ·mol-1
2SO3(g) ΔH=-196.0kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH="-113.0" kJ·mol-1
2NO2(g) ΔH="-113.0" kJ·mol-1
2SO3(l) 2SO3(g) ΔH=" 20.0" kJ·mol-1
2SO3(g) ΔH=" 20.0" kJ·mol-1
则NO2与SO2反应生成SO3(l)和一种无色气体的热化学方程式 ;
若在一定条件下,将NO2与SO2以体积比1:2置于恒容密闭容器中发生上述反应,
①下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 molNO2
②该反应达平衡时,测得NO2的转化率为50%,则反应前后容器内压强比为 。
③恒压密闭容器中发生上述反应时,若加入Ar气,使得反应速率 (变大、变小或不变)。
SO2(g)+NO2(g) SO3(l)+NO(g) △H=-51.5 kJ·mol-1
SO3(l)+NO(g) △H=-51.5 kJ·mol-1
①a,b ② 6:5 ③变小
考查盖斯定律的应用。由反应①2SO2(g)+O2(g) 2SO3(g) ΔH=-196.0kJ·mol-1、反应②2NO(g)+O2(g)
2SO3(g) ΔH=-196.0kJ·mol-1、反应②2NO(g)+O2(g) 2NO2(g) ΔH="-113.0" kJ·mol-1和③2SO3(l)
2NO2(g) ΔH="-113.0" kJ·mol-1和③2SO3(l) 2SO3(g) ΔH=" 20.0" kJ·mol-1可知,即①-②-③得2SO2(g)+2NO2(g)
2SO3(g) ΔH=" 20.0" kJ·mol-1可知,即①-②-③得2SO2(g)+2NO2(g) 2SO3(l)+2NO(g),所以其△H=-103 kJ·mol-1。
2SO3(l)+2NO(g),所以其△H=-103 kJ·mol-1。
①因为反应前后体积是变化的,所以当压强不再变化时,可以说明已经达到平衡。颜色的深浅与其浓度大小有关,所以当颜色不再变化时,也可以说明已经达到平衡状态。三氧化硫是液体,C不正确。消耗消耗1 mol SO3的同时必然生成1 molNO2 m,不能说明。
② SO2(g)+NO2(g) SO3(l)+NO(g)
SO3(l)+NO(g)
起始量(mol) 2 1 0 0
转化量(mol) 0.5 0.5 0.5 0.5
平衡量(mol) 1.5 0.5 0.5 0.5
反应前后容器内压强比为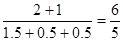 .
.
③恒压密闭容器中发生上述反应时,若加入Ar气,则容器的体积必然增大,即物质的浓度会减小,反应速率则降低。
