(12分)合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料。从天然气获得合成气过程中可能发生的反应有:
①CH4(g)+H2O(g) CO(g)+3H2(g) ⊿H1="+206.1" kJ/mol
CO(g)+3H2(g) ⊿H1="+206.1" kJ/mol
②CH4(g)+CO2(g) 2CO(g)+2H2(g) ⊿H2="+247.3" kJ/mol
2CO(g)+2H2(g) ⊿H2="+247.3" kJ/mol
③CO(g)+H2O(g) CO2(g)+ H2(g) ⊿H3
CO2(g)+ H2(g) ⊿H3
请回答下列问题:
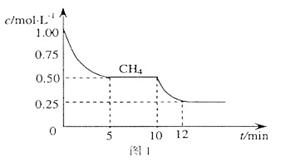
(1)在一密闭容器中进行反应①,测得 的物质的量浓度随反应时间的变化如图1所示。10min时,改变的外界条件可能是 。
的物质的量浓度随反应时间的变化如图1所示。10min时,改变的外界条件可能是 。
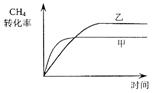
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的 和
和 ,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中
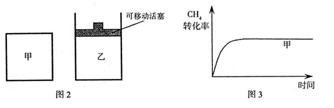
,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中 的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中
的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中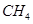 的转化率随时间变化的图像。
的转化率随时间变化的图像。
(3)反应③中 。800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
。800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:

此时反应③中正、逆反应速率的关系式是 (填代号)。
a. (正)
(正) (逆) b.
(逆) b. (正)<
(正)< (逆) c.
(逆) c. (正)=
(正)= (逆) d.无法判断
(逆) d.无法判断
(4)800K时下列起始体积相同的密闭容器中充入2mol SO2、1mol O2,其反应是2SO2(g)+O2(g)  2SO3(g);△H=-96.56 kJ•mol-1,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙容器维持绝热,三容器各自建立化学平衡。
2SO3(g);△H=-96.56 kJ•mol-1,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙容器维持绝热,三容器各自建立化学平衡。
【1】达到平衡时,平衡常数K (甲) K (乙) K(丙)(填“>”、“<”或“=”)。
【2】达到平衡时SO2的浓度C(SO2)(甲) C(SO2) (乙) C(SO2) (丙)(填“>”、“<”或“=”)。
(1) 升高温度
(2)
(3) —41.2 KJ/mol a (4) 【1】 = > 【2】< <
(1)分析图1,得:10min时,C(CH4)减小,则要求①中的平衡正向移动,而升温,可使该平衡正向移动;
(2)甲、乙在相同温度下发生反应②,且均向正向开始反应,甲中保持恒容,乙中保持恒压:
对乙而言,随着反应的正向进行,容积增大,则:P乙<P甲,而压强越小,反应速率越小,即:υ乙<υ甲,则用时:t乙>t甲;而压强减小,平衡②将正向移动,则CH4的转化率:乙>甲;
(3)① - ②= ③,则 ⊿H2-⊿H1=(206.1-247.3)=—41.2 kJ/mol;
⊿H2-⊿H1=(206.1-247.3)=—41.2 kJ/mol;
利用表中数据,得浓度积Q=[C(CO2)×C(H2)]/[C(CO)×C(H2O)]=(2×2)/(0.5×8.5)=0.94,
而K=1.0,即Q<K,平衡要正向移动,故 (正)
(正) (逆);
(逆);
(4)【1】甲、乙中温度相等,故K (甲)="K" (乙);
△H=-96.56 kJ•mol-1 <0,说明正向是放热反应,丙保持绝热,则反应放出的热量致使体系温度升高,而升温时,该平衡逆向移动,则K值减小,故K (甲)="K" (乙) > K(丙);
【2】甲、乙中比较:初始条件相同,甲保持压强不变,乙容器保持体积不变,则乙中:随着反应的正向进行,气体的量减少,则P乙<P甲,而压强减小时,平衡将逆向移动,故C(SO2)(甲)<C(SO2) (乙);
乙、丙中比较:初始条件相同,乙容器保持体积不变,丙容器维持绝热,则丙中:反应放出的热量致使体系温度升高,而升温时,该平衡逆向移动,故C(SO2) (乙) <C(SO2) (丙);
