(16分)Ⅰ.依据氧化还原反应:2Ag+(aq)+Cu(s) ===Cu2+(aq) +2Ag(s)设计原电池,请回答下列问题:
(1)负极材料是____________;电解质溶液是____________;
(2)正极发生的电极反应为________________________;
(3)电解质溶液中Ag+向_________极移动。
Ⅱ.一定温度下在某定容容器中发生反应:2A(g) +3B(g) ===2C(g),开始时,A的浓度为2 mol·L -1,B的浓度是4 mol·L-1,2 min后,A的浓度减少0.8 mol·L-1,则
(1)v(B) =___________,v(C) =____________。
(2)在2min末,C的浓度是____________,B的浓度是____________。
(16分,每空2分)Ⅰ.(1)Cu AgNO3溶液 (2)2Ag++2e-===2Ag (3)正
Ⅱ.(1)v (B) =" 0." 6 mol · L -1 ·min-l v (C) =" 0.4" mol · L -1 ·min-l
(2)c (C) ="0." 8 mol /L c (B) =" 2." 8 mol / L
Ⅰ.(1)在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。根据反应式可知,铜失去电子,作负极。电解质溶液中Ag+向正极移动,所以溶液中的银离子得到电子,所以电解质溶液是硝酸银。正极反应式为2Ag++2e-===2Ag。
Ⅱ.(1)A的浓度减少0.8 mol·L-1,则B的浓度减少1.2 mol·L-1,C的浓度增加0.8 mol·L-1,所以B、C的反应速率是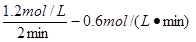 、
、 。
。
(2)消耗B是1.2 mol·L-1,所以B的浓度是4.0 mol·L-1-1.2 mol·L-1=2.8 mol·L-1 .
