某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积KW= 。在此温度下,将 pH = a的 NaOH 溶液 Va L 与 pH = b的 H2SO4溶液 Vb L 混合。
(1)若所得混合液为中性,且 a= 12,b= 2,则 Va∶Vb= ;
(2)若所得混合液为中性,且 a+ b= 12,则 Va∶Vb= ;
(3)若所得混合液的 pH = 10,且 a= 12,b= 2,则 Va∶Vb= 。
(12分)
KW=10-13
(1)1:10 (2)10:1 (3)1:9
题目分析:解:0,01mol/l的NaOH溶液中C(OH-)=0.01mol/L=10-2mol/L,
pH为11的氢氧化钠溶液中C(H+)=10-11mol/L。
该温度下水的离子积常数Kw=C(H+)*C(OH-)= 10-11mol/L*10-2mol/L=10-13(mol/L)2。
①pH=12的NaOH溶液中C(H+)=10-12mol/L
则氢氧化钠溶液中C(OH-)=Kw/C(H+)=10-13(mol/L)2/10-12mol/L=10-1mol/L
pH=2的硫酸中C(H+)=10-2mol/L,
若所得混合液为中性,则C(H+)*Vb=C(OH-)*Va,
Va:Vb=10-2:10-1=10-2:10-1=1:10。
②所得混合液为中性,则C(H+)*Vb=C(OH-)*Va;且 a+ b= 12,
Va:Vb=C(H+):C(OH-)=C(H+):[Kw/C(H+)]=10-b:10-13+a=1013-a-b=10:1。
③pH=12氢氧化钠溶液中C(OH-)=10-1mol/L,
pH=2的硫酸中C(H+)=10-2mol/L,
pH=10的溶液中C(OH-)=10-13(mol/L)2/10-10mol/L=10-3mol/L,
若所得混合液的pH=10,则说明碱过量,
C(OH-)*Va-C(H+)*Vb=10-1mol/L*Va-10-2mol/L*Vb=(Va+Vb)*10-3mol/L,
解得:Va:Vb=1:9。
点评:
1、强酸、强碱溶液的pH
强酸直接由酸的浓度求出c(H+),强碱先由碱的浓度求出c(OH-),再根据水的离子积换算出c(H+),然后用公式Kw = c(H+)·c(OH—)=1×10-14 pH=" -" lg c(H+)求解
2、两强酸混合抓住氢离子进行计算 2、两强碱混合抓住OH-进行计算,再转化为H+
c (H+) = 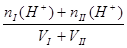 c (OH-])=
c (OH-])= 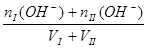
经验规律:(1)两强酸等体积混合 混合后的pH=小的+0.3
(2)两强碱等体积混合 混合后的pH=大的—0.3
3、强酸、强碱混合,酸过量抓住氢离子进行计算、碱过量抓住氢氧根离子进行计算。
(3)酸I+碱II
完全中和:c(H+)= c(OH-) = 1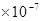 mol/L
mol/L
酸过量: c(H+)= 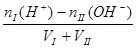 碱过量:c(OH-)=
碱过量:c(OH-)= 
