(12分)在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=________。已知:K300 ℃>K350 ℃,则该反应是________热反应。
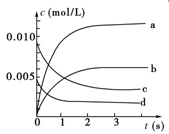
(2)如图中表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=_____ ___。
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向逆反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
(12分)(1)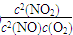 放
放
(2)b 1.5×10-3mol/(L·s) (3)bc (4)b
2NO(g) + O2(g)  2NO2(g)
2NO2(g)
初始c: 0.01 0.005 0
△c: 0.0065 0.00325 0.0065
3s c: 0.0035 0.00125 0.0065
(1)K300 ℃>K350 ℃,说明升高温度,K减小,平衡左移,正反应是放热反应
(2)由表中数据结合图像可知b线为NO2的变化的曲线;
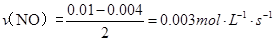 ,而
,而
(3)平衡状态即正逆反应速率相等(c可表明),各物质的浓度不再改变(b可表明);由于各气体的质量恒定的,不能做为平衡的标志
(4)催化剂不能影响平衡的移动;增大O2的浓度、及时分离出NO2气体均会使平衡正向移动;故就选择升高温度,速率增大了,同时平衡向吸热方向移动,即逆向移动。
