pH=10的NaOH和pH=12的Ba(OH)2等体积混合后,溶液的pH值为
A.11.7
B.10.3
C.11.4
D.11.0
答案:A
【错解分析】(1)已知两种溶液的pH值,求混合后溶液的pH值,往往从两种酸入手。一是pH值与氢离子浓度相互换算较为简单、直观,二是计算推断与事实相符不易错。但也易形成思维定势,遇到任何两种溶液混合,先求混合液的[H+],再求其pH值。如:两种碱溶液等体积混合,由于将氢离子视为溶质,按下式求混合液的氢离子浓度:
pH=10的NaOH,其[H+]=1×10-10mol·L-1;
pH=12的Ba(OH)2,其[H+]=1×10-12mol·L-1;
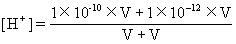
=50.5×10-12mol·L-1
进而计算出混合液的pH值为10.3,得出错误选项B的结论。
实际上碱溶液的溶质应是氢氧根离子,其浓度随溶液体积变化而变化。而碱溶液中的氢离子是由水电离生成,其浓度只随上述溶质氢氧根离子浓度变化而变化,两者乘积为水的离子积。两种碱溶液混合,其溶质也应是氢氧根离子。计算混合液的氢氧根离子浓度,再由水的离子积计算氢离子浓度,进而计算混合液的pH值。
(2)由溶液pH值求出的氢离子浓度,是溶液中已电离的氢离子浓度,对于多元强酸来说,它应是酸的物质的量浓度和其元数的乘积。由于上述关系不清,常常误将pH值求出的氢离子浓度再与酸的元数相乘视为其氢离子浓度。因而得出错误选项C。对于多元强碱也易发生类似错误。
【正解】本题的正确解法为:
pH=10[H+]=1×10-10mol·L-1,[OH-]=1×10-4mol·L-1
pH=12[H+]=1×10-12mol·L-1,[OH-]=1×10-2mol·L-1
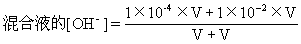
=50.5×10-4mol·L-1
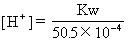
=2×10-12mol·L-1
pH=11.7
