问题
选择题
在25mL 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1CH3COOH溶液,溶液pH变化曲线 如图所示,列有关离子浓度的比较正确的是 ( )
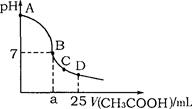
A.在A、B间任一点(不含A、B点),溶液中可能有c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.在D点,c(CH3COO-)+c(CH3COOH)=c(Na+)
答案
答案:A
题目分析:在A、B间任一点(不含A、B点),溶液是碱性的,溶液中可能有c(Na+)>c(OH-)>c(CH3COO-)>c(H+) ;在B点,如果是强酸,a="12.5" 。而醋酸是弱酸,所以a>12.5,且有c(Na+)<c(CH3COO-) c(OH-)=c(H+) ; 在C点溶液现酸性,所以c(CH3COO-)>c(Na+)>c(H+)>c(OH-);在D点,c(CH3COO-)+c(CH3COOH)>c(Na+),故选A。
点评:强碱和弱酸溶液混合后,溶液中离子浓度的大小比较:
呈碱性包括两种情况;强碱和强碱弱酸盐的混合溶液及单一强碱弱酸盐溶液;
呈中性: 强碱弱酸盐和少量弱酸的混合溶液;
呈酸性:强碱弱酸盐和大量弱酸的混合溶液。
