(14分)常温时,在稀溶液中c(H+)和c(OH-)的乘积总是等于 。
(1)酸性溶液c(H+) (填“>”、“<”或“=”,下同)c(OH-),pH 7。
人的胃液中含有盐酸,经测定某人胃液的pH为2,则其中的c(H+)= mol/L。
食醋常用于食品调味,其主要成分为醋酸,醋酸的电离方程式为 。
(2)室温下,pH均为3的盐酸和醋酸溶液,下列各项中相等的是 (填序号)。
①溶液中c(H+) ②酸的物质的量浓度 ③完全中和时,消耗NaOH的质量
(3)在①NaCl、②CH3COONa、③NH4Cl三种盐溶液中,常温下呈酸性的是 (填序号,下同)), 呈中性的是 , 呈碱性的是 。
(4)氯化铁水解的离子方程式为 ,配制氯化铁溶液时滴加少量盐酸的作用是 。
(14分)1×10-14
(1)> < 0.01 CH3COOH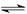 CH3COO-+H+
CH3COO-+H+
(2)① (3)③ ① ②
(4)Fe3++3H2O Fe(OH)3+3H+ 抑制Fe3+水解
Fe(OH)3+3H+ 抑制Fe3+水解
题目分析:常温时,在稀溶液中c(H+)和c(OH-)的乘积就是是的离子积常数,数值等于1×10-14。
(1)常温下酸性溶液中氢离子浓度是大于c(OH-),此时pH大于7;氢离子浓度的负对数是pH,所以在pH=2的情况下,c(H+)=0.01mol/L。醋酸是弱酸,部分电离,电离方程式是
CH3COOH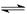 CH3COO-+H+。
CH3COO-+H+。
(2)由于盐酸是强酸,而醋酸是弱酸,所以在pH均为3的盐酸和醋酸溶液中,氢离子浓度是相等的,但醋酸的浓度大于盐酸的,所以醋酸消耗的氢氧化钠多,答案选①。
(3)氯化钠是强酸强碱盐,不水解,溶液显中性;醋酸钠是强碱弱酸盐,水解显碱性;氯化铵是强酸弱碱盐,水解显酸性。
(4)氯化铁也是强酸弱碱盐,铁离子水解,生成氢氧化铁和盐酸,所以配制氯化铁溶液时滴加少量盐酸的作用是抑制铁离子的水解。
点评:在判断溶液酸碱性,不能直接根据pH和7的大小进行比较,因为只有在常温常压下,才是符合该关系式的。而氢离子和OH-浓度的相对大小是在任何条件下都是成立的。
