(11分)草酸晶体的组成可用H2C2O4·xH2O表示,为了测定x值,进行如下实验:
称取Wg草酸晶体,配成100.00mL无色水溶液。量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol·L-1的KMnO4溶液滴定。试回答:
(1)滴定时所发生反应的化学方程式为
(2)草酸是二元弱酸,则草酸的电离方程式为 请从“电离平衡”的角度解释:为什么草酸的第二步电离比第一步难
图I表示100mL量筒中液面的位置,A与B,B与C刻度间相差10mL,如果刻度A为30,量筒中液体的体积是___________mL。图II表示25mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)_____________。
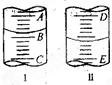
A.是amL
B.是(25-a)mL
C.一定大于amL
D.一定大于(25-a)mL(3)实验中,标准液KMnO4溶液应装在_______式滴定管中。若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得的x值会_____(偏大、偏小、无影响)达到滴定终点,溶液由 色变为 色;
(4)在滴定过程中若用amol·L-1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为_______mol·L-1;
(5)若测得x=2,称取某二水合草酸晶体0.1200 g,加适量水完全溶解,然后用0.02000 mol·L-1的酸性KMnO4溶液滴定至终点(杂质不参与反应),滴定前后滴定管中的液面读数如图所示,则该草酸晶体样品中二水合草酸的质量分数为 。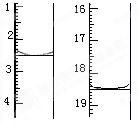
(1) 2KMnO4 +5H2C2O4 + 3H2SO4 = K2SO4 + 10CO2↑ +2MnSO4 + 8H2O
(2) H2C2O4 H++HC2O4-、HC2O4-
H++HC2O4-、HC2O4- H++C2O42-,第一步电离产生的氢离子抑制第二步电离 22.0 D
H++C2O42-,第一步电离产生的氢离子抑制第二步电离 22.0 D
(3)酸 无影响 无色 紫红
(4)0.1aVmol/L
(5)84.00%
题目分析:(1)高锰酸钾和草酸溶液反应化学方程式为2KMnO4 +5H2C2O4 + 3H2SO4 = K2SO4 + 10CO2↑ +2MnSO4 + 8H2O。
(2)草酸电离方程式为:H2C2O4 H++HC2O4-、HC2O4-
H++HC2O4-、HC2O4- H++C2O42-,第一步电离产生的氢离子抑制第二步电离。
H++C2O42-,第一步电离产生的氢离子抑制第二步电离。
量筒刻度由下向上逐渐增大,每一格表示2.0mL,量筒中液体的体积为22.0mL;滴定管刻度从上到下增大,最大刻度下面还有部分液体,滴定管中液体的体积一定大于(25-a)mL。
(3)高锰酸钾溶液有强氧化性,应盛装在酸式滴定管中,若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得的x值无影响,终点现象是滴加最后一滴高锰酸钾溶液,溶液由无色变为紫红色且30s不褪色。
(4)2KMnO4 ~ 5H2C2O4
2 5
0.001avmol 0.025c
c=0.1avmol/L
(5)消耗高锰酸钾溶液体积为16.00mL。设草酸晶体物质的量为nmol。
5H2C2O4·2H2O~2 KMnO4
5 2
nmol 0.02×0.016mol
n=0.0008mol
H2C2O4·2H2O质量分数为84%。
点评:用高锰酸钾溶液滴定草酸因高锰酸钾溶液本身有颜色,不需外加指示剂。
