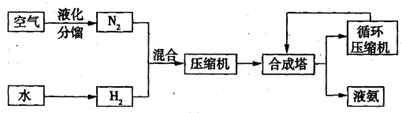
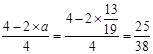(11分)氨在国民经济中占有重要的地位,2008年,我国氨产量接近500万吨。下图是合成氨的简要流程。
(1)天然气、重油、煤都可以与水反应制得氢气。下表是某合成氨厂采用不同原料的相对投资和能量消耗。
| 原料[ | 天然气 | 重油 | 煤 |
| 相对投资费用 | 1.0 | 1.5 | 2.0 |
| 能量消耗/J·t—1 | 28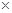 109 109 | 38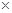 109 109 | 48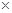 109 109 |
②请写出甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式: 。
③已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)===CO2(g) △H=-394kJ·mol—1;
2CO(g)+O2(g)===2CO2(g)△H=-566kJ·mol—1;
2H2(g)+O2(g)===2H2O(g)△H="-484" kJ·mol—1;
试写出由C与水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式 。
(2)下表是在某种催化剂作用下用体积比为1:3的氮、氢混合气反应应达到平衡时的一些实验数据。
①依据表中数据判断,合成氨反应N2+3H2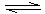 NH3的△H 0(填“>”、“<”或“无法判断”
NH3的△H 0(填“>”、“<”或“无法判断” ,请简要说明理由 ;
,请简要说明理由 ;
②该反应的化学平衡常数表达式为 。
③在300℃、10MPa下,合成氨反应达到平衡时,混合气体的体积是反应开始时的 倍。
(11分)
(1)①天然气(1分) ②CH4 + H2O 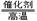 CO + 3H2(2分)
CO + 3H2(2分)
③ C(s)+ H2O(g)= CO(g) + H2(g)△H =131kJ•mol-1 (2分)
(2)① <(1分) 相同条件下,升高温度, NH3含量减小,平衡左移, 逆反应吸热,正反应放热;(2分)
②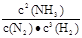 (1分) ③ 0.658或
(1分) ③ 0.658或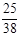 (2分)
(2分)
(1)①相同的能量消耗,天然气的费用最低。
③由下面两反应:
C(s)+O2(g)===CO2(g) △H=-394kJ·mol—1;
2CO(g)+O2(g)===2CO2(g)△H=-566kJ·mol—1;
可求得:C(s)+1/2O2(g)===CO(g) △H=-111kJ·mol—1
结合:2H2(g)+O2(g)===2H2O(g)△H="-484" kJ·mol—1
可推出:C(s)+ H2O(g)= CO(g) + H2(g)△H =131kJ•mol-1
(2)③ N2 + 3H2 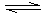 NH3
NH3
初始: 1 3 0
△n: a 3a 2a
平衡n: 1—a 3—3a 2a
由题意,结合表中数据可知: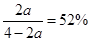 ,解出a=13/19
,解出a=13/19
则: