用中和滴定法确定某烧碱样品的浓度,试根据实验回答下列问题:
(1)准确称取一定量的样品,配成500 mL待测溶液。称量时,样品可放在 (填编号字母)上称量
(A)小烧杯 (B)洁净纸片 (C)直接放在托盘上
(2)准确量取10.00ml待测液于锥形瓶中,用0.2000mol·L-1的盐酸来滴定待测溶液,不可选用 (填编号字母)作指示剂。 (A)甲基橙 (B)石蕊 (C)酚酞
(3)若选用甲基橙作指示剂,滴定终点的判断依据是
此时溶液显 性。
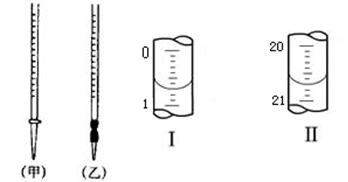
(4)0.2000mol·L-1的盐酸应装在下图所示的 (填甲、乙)中,图Ⅰ所示为滴定前液面,图Ⅱ所示为滴定结束时液面,根据图示计算被测烧碱溶液的物质的量浓度是 mol·L-1。
(5)下列实验操作会对滴定结果产生的后果。(填“偏高”、“偏低”或“无影响”)
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果 。
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果 。
(1)(A) (2)(B)
(3)当加入最后一滴标准的酸液时,溶液刚好由黄色变为橙色,且半分钟无变化 酸
(4)甲 0.4000 (5)①偏高 ②偏高
题目分析:(1)氢氧化钠是易潮解的物质,所以称量时必须要用烧杯或表面皿。
(2)石蕊的变色范围为5—8,变色范围较大,不适宜做指示剂。
(3)酸滴碱用甲基橙做指示剂,甲基橙的颜色由黄变为橙色,所以滴定终点的判断依据是当加入最后一滴标准的酸液时,溶液刚好由黄色变为橙色,且半分钟无变化,甲基橙的变色范围是3.1-4.4,此时溶液呈酸性。
(4)盐酸应该用酸式滴定管盛装,因此选择甲。如图可以看出所用酸的体积为20.00mL,根据c(H+)V(H+)= c(OH-)V(OH-),可以求出NaOH的浓度为0.4000。
(5)c(OH-)=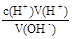 ,开始俯视,滴定终点平视,所用HCl的体积比正常值大,所以偏高。若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,所用HCl的体积比正常值大,所以偏高。
,开始俯视,滴定终点平视,所用HCl的体积比正常值大,所以偏高。若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,所用HCl的体积比正常值大,所以偏高。
点评:酸碱中和滴定是化学实验的基础题,其中要重视滴定终点的判断。
